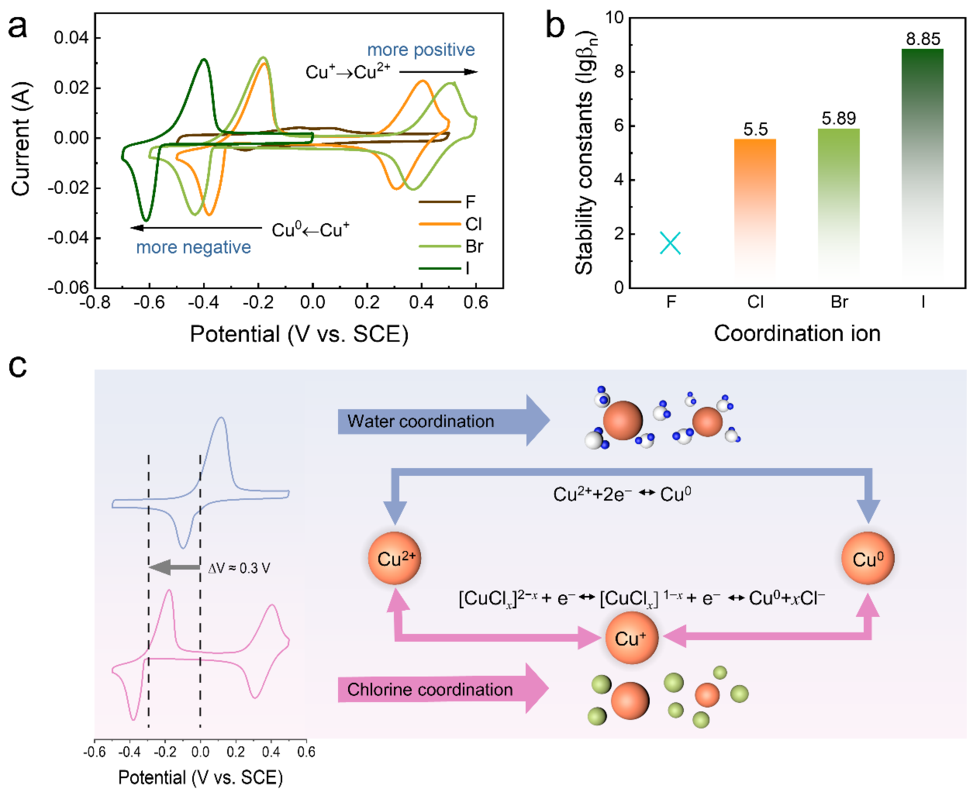
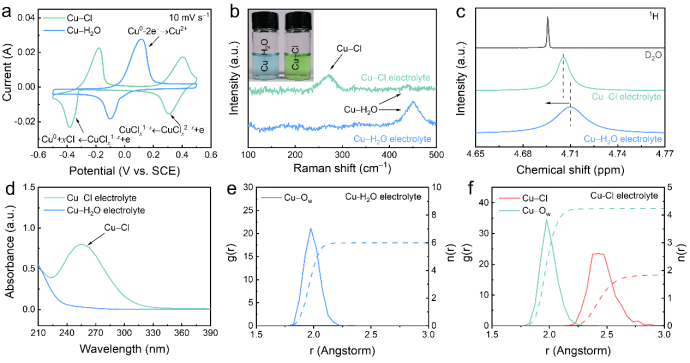
近年来,水系铜基电池因其出色的特性备受关注,但其应用受制于铜负极的高电位(0.34 V vs. 标准氢电极),导致现有的电化学体系常常无法提供足够高的电压(通常小于1 V),以满足特定应用的需求。近日,松山湖材料实验室支春义研究员、南方科技大学李洪飞助理教授和深圳大学刘卓鑫助理教授合作,提出了一种配位策略来降低水铜基电池的本征负极氧化还原电位,从而提高其工作电压。这是通过Cl−离子调整电解质来建立适当的配位环境来实现的。当与氯配位时,水系电解质中的中间体Cu+离子被成功稳定,并且电化学过程被解耦为涉及Cu2+/Cu+和Cu+/Cu0的两个独立的氧化还原反应;其中Cu+/Cu0的氧化还原电位比Cu2+/Cu0的低了大约0.3V。同时,与水配位相比,氯配位提高了铜利用率、氧化还原动力学和循环稳定性。此外,利用电解液中过量的Cl−离子,构建了一种利用正极Cl−/Cl2氧化还原反应的水系铜-氯电池体系,表现出1.3 V的高放电电压平台,并且在10000次循环后仍保留了77.4%的初始容量。这项工作可能为提高水系铜电池的电压开辟一条途径。其成果以题为“Manipulating coordination environment for a high-voltage aqueous copper-chlorine battery”在国际知名期刊Nature Communications上发表,本文第一作者为张祥勇(松山湖材料实验室与深圳大学联合培养博士后)。

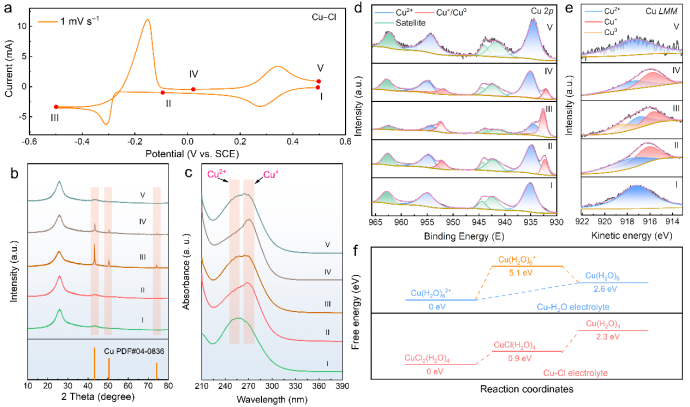
通过非原位分析包括X射线衍射、UV-Vis光谱、X射线光电子能谱(XPS)和X射线激发俄歇电子谱(XAES)对铜离子的氧化还原机制进行深入解析。结果表明,在氯配位下铜离子发生可逆的氧化还原反应,具体包括Cu2+/Cu+和Cu+/Cu0之间的转化。 此外,理论模拟结果与实验数据相符,进一步支持了所提出的反应机制。根据所获得的结果,氯配位环境下铜离子的电化学过程如下(其中x=1-4,代表配位数):
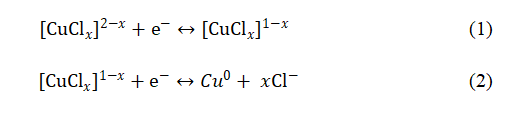
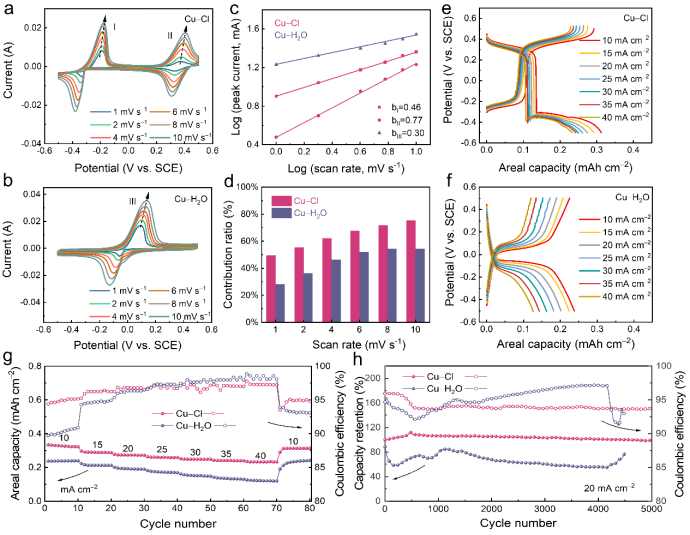

通过将0.5 M HCl加入Cu-Cl电解液以提高电极的稳定性,实现了88%的容量保持率。
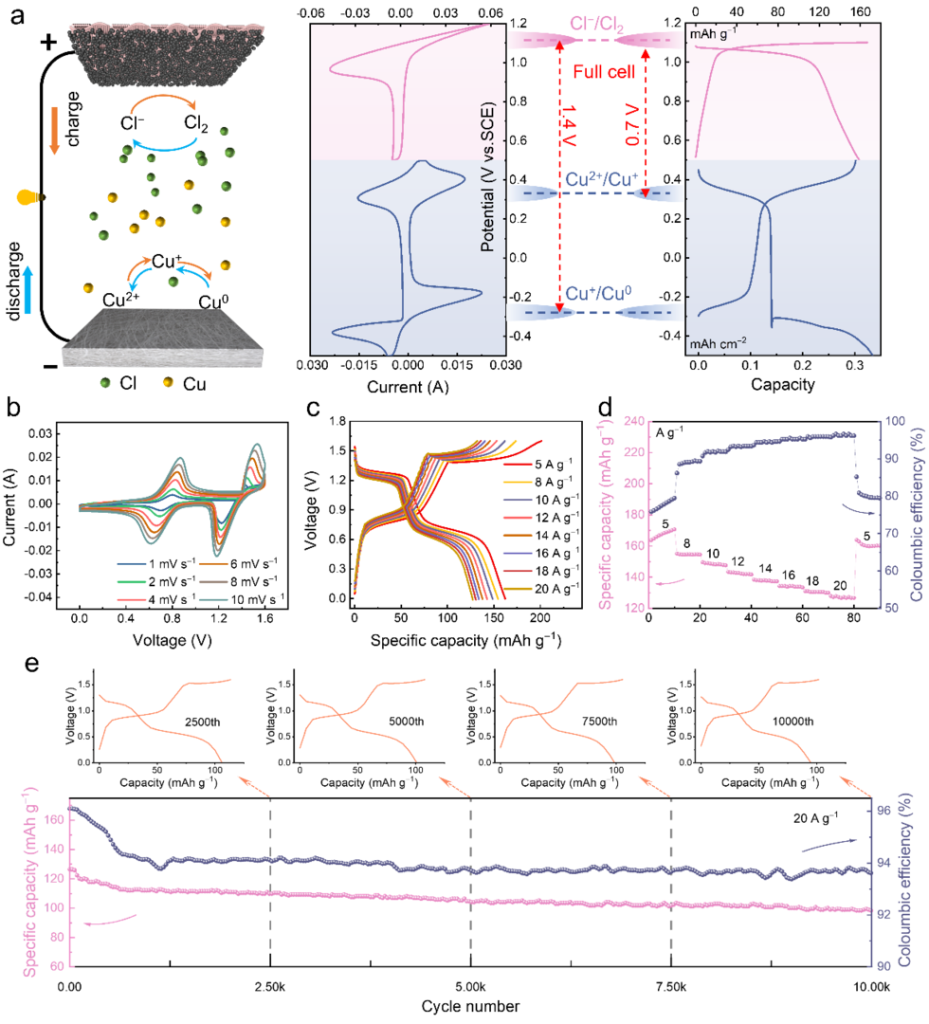
本文深入研究了氯配位对铜氧化还原电位的影响,以获得高压水系铜基电池。由于其与Cu+的络合,Cl−可以稳定水系电解质中的Cu+,使得Cu+/Cu0的氧化还原反应能够在比常规Cu2+/Cu0反应低约0.3V的电位下发生。与水配位相比,氯配位下的铜负极在10 mA cm−2下也表现出更高的面积容量、更快的氧化还原动力学和更高的循环稳定性,在20 mA cm-2下循环5000次后容量保持率达到99%。最后,采用Cl−/Cl2作为正极反应原位构建了Cu-Cl2全电池。该电池提供了1.3 V的高放电平台,并且在5 A g−1下具有162 mAh g−1的放电容量(基于科琴黑的质量)。它还表现出出色的倍率性能和良好的循环稳定性,在10000次循环后仍保留了77.4%的初始容量。本研究中使用的策略——调节配位环境——降低了负极电位,改善了电化学动力学,并增强了循环稳定性。这些发现可以为高性能水系电池的未来发展提供线索。
本文撰稿:张祥勇
